-
擅长:
反应原理:2NH4Cl+Ca(OH)2=△= CaCl2+2NH3↑+2H2O
反应装置:固体+固体加热制气体装置。包括试管、酒精灯、铁架台(带铁夹)等。
净化装置(可省略):用碱石灰干燥。
收集装置: 向下排空气法,验满方法是用湿润的红色石蕊试纸置于试管口,试纸变蓝色;或将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生。
尾气装置:收集时,一般在管口塞一团棉花球,可减少NH3与空气的对流速度,收集到纯净的NH3.
注意事项: 不能用NH4NO3跟Ca(OH)2反应制氨气。硝酸铵受撞击、加热易爆炸,且产物与温度有关,可能产生NH3、N2、N2O、NO。 实验室制NH3不能用NaOH、KOH代替Ca(OH)2。因为NaOH、KOH是强碱,具有吸湿性(潮解)易结块,不易与铵盐混合充分接触反应。又KOH、NaOH具有强腐蚀性在加热情况下,对玻璃仪器有腐蚀作用,所以不用NaOH、KOH代替Ca(OH)2制NH3。 用试管收集氨气要堵棉花。因为NH3分子微粒直径小,易与空气发生对流,堵棉花目的是防止NH3与空气对流,确保收集纯净;减少NH3对空气的污染。 实验室制NH3除水蒸气用碱石灰,而不采用浓H2SO4和固体CaCl2。因为浓H2SO4与NH3反应生成(NH4)2SO4。NH3与CaCl2反应能生成CaCl2·8NH3(八氨合氯化钙)。CaCl2+8NH3= CaCl2·8NH3 反应原理:NH3·H2O =△= NH3↑+H2O。
这种方法一般用于实验室快速制氨气。
装置:烧瓶,酒精灯,铁架台,橡胶塞,导管等。
注意事项:加热浓氨水时也会有水蒸气,需要用干燥装置除杂。同上,这种方法制NH3除水蒸气用碱石灰,而不要采用浓H2SO4和固体CaCl2。 反应原理:浓氨水中存在以下平衡:
NH3+H2O←→ NH3·H2O←→NH4+ +OH-,
加入固态碱性物质(如CaO,NaOH,碱石灰等),消耗水且使c(OH-)增大,使平衡移动,同时反应放热,促使NH3·H2O的分解。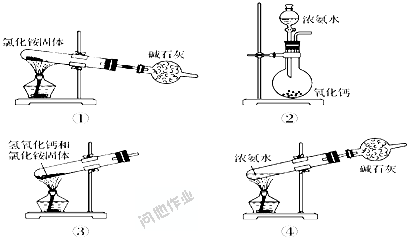 5人赞同 2018-09-06发表于
5人赞同 2018-09-06发表于 -

 氨气实验室制法的研究与改进
氨气实验室制法的研究与改进
氨气实验室制法的研究与改进
氨气实验室制法的研究与改进 吐逊阿衣·艾买提 (一)氨气的实验室制取方法一 1、实验仪器和药品 仪器 :铁架台、铁夹、酒精灯、木砖、试管、试管塞、三通管、橡胶管、止 水夹、橡皮筋、玻璃导管、集气瓶、双孔橡皮塞、药匙、火柴。 药品 :氯化铵、消石灰、红色石蕊试纸、蒸馏水。 2、实验装置图(如图 1) 图 1 A.用于加热反应物 B. 用于收集氨气 C. 用于检满 D.用于吸收多余的氨气 E. 用于防止倒吸 a.氯化铵和消石灰混合物 b. 润湿的红色石蕊试纸 ①,②,③,④均为止水夹 3、实验操作步骤 (1)按图装好仪器,打开①、②、③、④,在 D中装入水或稀硫酸, E中 装入水。 (2)检查气密性 :用酒精灯稍微加热试管 A,若 D中有气泡产生,则已密封 好。 (3)用橡皮筋装好润湿的红色石蕊试纸 b。 (4)取下 A装入氯化铵和消石灰盖

 关于氨气浓度标准的解释..
关于氨气浓度标准的解释..
关于氨气浓度标准的解释..
关于氨气浓度的标准 根据国标 TJ36-79 规定,氨属车间空气中的有害物质, 所以是有 毒气体,在《职业性接触毒物危害程度分级》 GB5044-1985规定属于 Ⅳ级 (轻度危害 );但根据《可燃气体和有毒气体检测报警仪安装规 范.使用规范.设计规范》 GB5044-83中相关规定,没有明确说明氨 气属可燃气体有毒气体, 所以油化工企业可燃气体有毒气体检测报警 设计规范不规定检测。 在《室内空气质量标准》 GB/T18883-2002规定:氨在室内空气 中最高允许浓度为 0.2mg/m3。(合 0.2635ppm);但在《工业企业设计 卫生标准》(TJ 36—79)第三章车间卫生第三十二条 车间空气中 有害物质的浓度, 不得超过表 4的规定,车间空气中有害物质的最高 容许浓度 ,氨为 30 mg/m3(合 39.53ppm)。 关于排放标准在《恶臭污染物排放标准》 GB 14554-93
-
擅长:
①铵盐与碱加热制取氨气,常用NH4Cl与Ca(OH)2反应,固体与固体反应,试管要向下倾斜。
②在浓氨水中加碱或生石灰,因为氨水中存在下列平衡:
NH3+H2O NH3·H2O NH4++OH-加入碱平衡左移,同时放出大量的热促进氨水的挥发。
③加热浓氨水,加快氨水挥发。
73人赞同 2018-09-07发表于


